关于不同年龄阶段肠道微生物组和耐药组如何响应抗生素的知识仍然有限。在这里,作者使用丹麦婴儿和年轻人的宏基因组数据表明,与婴儿相比,抗生素对成年人的影响更持久。
丹麦哥本哈根大学 Morten Arendt Rasmussen 和 Søren Johannes Sørensen 在 Nature Communications 杂志上发表了文章 Differential responses of the gut microbiome and resistome to antibiotic exposures in infants and adults。
在这项 COPSAC 队列的横断面子研究中,研究人员对队列中 217 名年轻人(中位年龄为 18 岁)的粪便进行宏基因组测序,并使用宏基因组分箱将 ARGs(Antibiotic Resistance Genes,抗生素耐药基因)与其细菌宿主相关联,从而深入了解 ARGs 在不同细菌物种中的分布。此外,在成年人和 1 岁(中位年龄)婴儿之间,他们还全面比较了宿主携带的 ARGs 与细菌/质粒中的 ARGs 的丰度和群落组成,并探讨了耐药基因谱差异的根本原因。最后,研究人员研究并比较了常规抗生素治疗对婴儿和成人肠道微生物组的影响,此影响通过微生物组成、抗生素耐药性和可移动遗传元件(包括质粒)的变化进行评估。

主要研究内容:
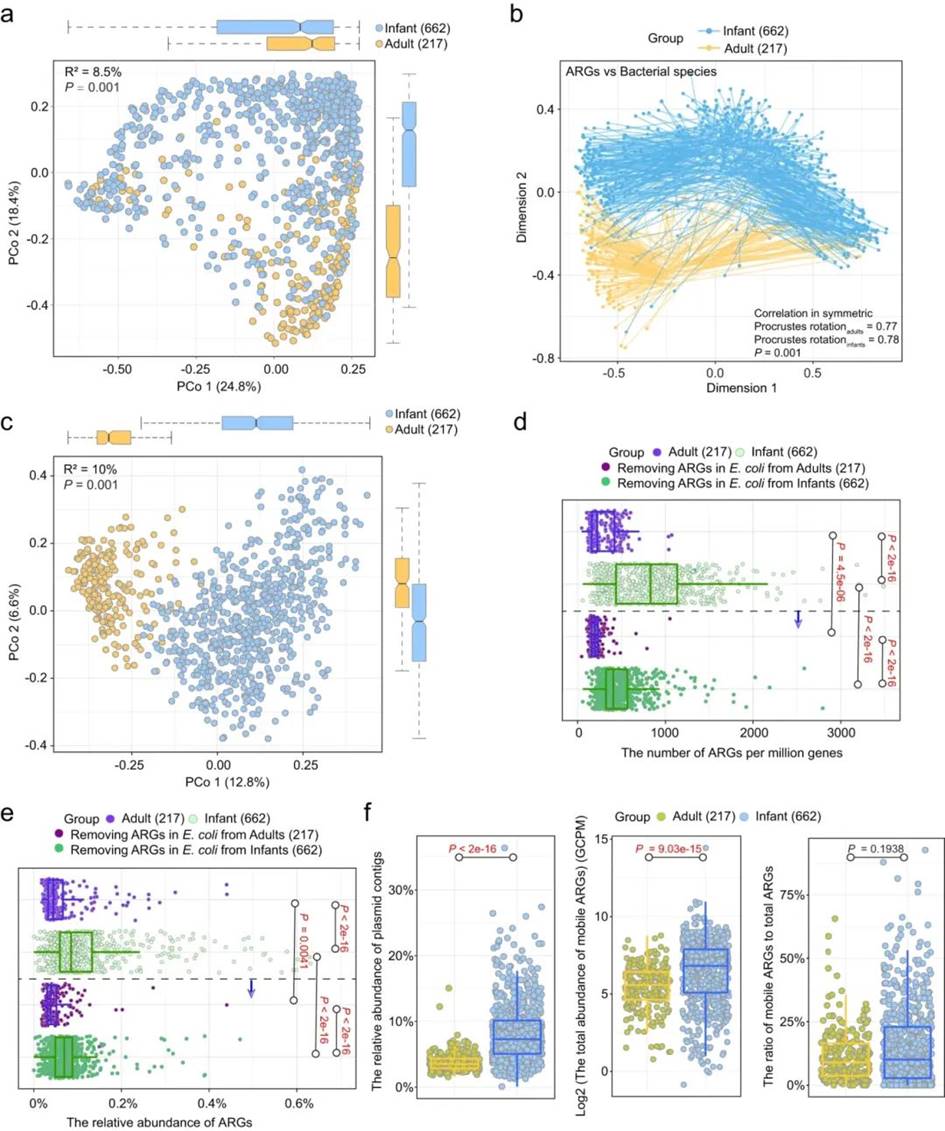
婴儿肠道中的 ARGs 比成人更丰富,其中大肠杆菌是最大的单一贡献者
研究人员对丹麦成人和婴儿中的 ARGs 进行了全面比较。总体而言,成人和婴儿之间的 ARGs 图谱存在显著差异(β-多样性(Bray–Curtis),PERMANOVA;R2 = 8.5%,P = 0.001,图 a)。Procrustes 分析显示,成人和婴儿肠道中细菌群落的组成与 ARGs 的组成之间存在显著相关性(permutational test;r_adults = 0.77,r_infants = 0.78,P = 0.001,图 2b),这表明无论宿主年龄如何,ARGs 的分布都与总体细菌组成密切相关。β-多样性分析还突显了成人和婴儿之间肠道微生物组成的显著差异(β-多样性,PERMANOVA;R2 = 10%,P = 0.001,图 c)。此外,在检测到的 896 种细菌中,有 482 种(54%)在两个年龄组之间的丰度存在差异(Wilcoxon test;FDR adjusted P < 0.05),这表明成人和婴儿之间的差异受到总体细菌组成的影响。考虑到成人和婴儿中大肠杆菌都含有较大比例的 ARGs,且相对丰度也不同。因此研究者删除了两个组中与大肠杆菌相关的 ARGs,并重新进行评估。结果显示,两个组的 ARGs 图谱的差异百分比并没有减少,这表明大肠杆菌并不是形成年龄相关差异的唯一因素。总之,两个年龄组之间 ARGs 图谱的差异是源于细菌群落的协同影响,而不是由单个重要细菌驱动的。
从每百万基因中 ARGs 的数量和 ARGs 的相对丰度(Wilcoxon test;P < 0.001,图 d、e)可以看出,婴儿肠道中的 ARGs 比成人肠道中的 ARGs 更丰富。当从分析中删除大肠杆菌相关的 ARGs 时,成人和婴儿之间每百万基因中 ARGs 的平均数量和 ARGs 的平均相对丰度的差异分别下降了 53% 和 51%(图 d、e)。这些发现表明大肠杆菌在影响成人和婴儿肠道 ARG 负荷差异方面发挥着重要作用。
质粒是重要的移动遗传元件,可在细胞间转移 ARGs。因此,研究人员专门研究了成人和婴儿肠道中质粒中携带的移动 ARGs。与总体分析一样,婴儿肠道中质粒和移动 ARGs 的丰度高于成人肠道(Wilcoxon test;P < 0.001,图 f)。然而,质粒中的移动 ARGs 相对于总 ARGs 的比例在两者之间没有差异(Wilcoxon test;P = 0.19)。
图片来源:Nature Communications
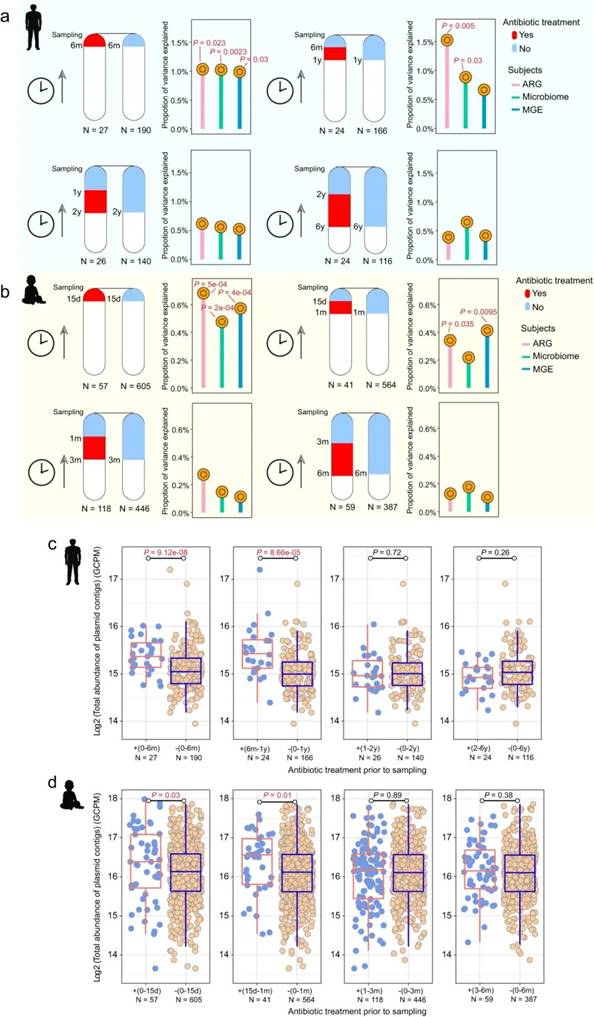
与婴儿相比,成人接受抗生素治疗后对微生物组成、ARG 和 MGE 图谱以及质粒丰度的影响更持久
众所周知,抗生素治疗会改变肠道微生物群,但这种影响程度是否因年龄而异尚未得到确定。在这里,研究人员在成人和婴儿中,比较了抗生素治疗与肠道微生物组改变之间的关系,特别是微生物组成、ARGs 和 MGEs(Mobile Genetic Elements,可移动遗传元件)的差异,其中包括与移动性相关的遗传元件,例如整合酶、转座酶和插入序列。在成人组中,抗生素治疗的影响可持续长达约一年。相反,对于婴儿来说,抗生素治疗的影响持续约 1 个月。具体而言,与未使用抗生素的成年人相比,在取样前 6 个月内或 6 个月至 1 年内使用过抗生素的成年人肠道中的 ARG 图谱和微生物群落组成显著不同(β-多样性,PERMANOVA;<6 个月,P 分别为 0.023、0.0023;6 个月-1 年,P 分别为 0.005、0.03;图 a)。相反,MGE 图谱仅在取样前 6 个月内使用过抗生素的组中存在差异(<6 个月,P = 0.03,图 a)。当在取样前 1 年以上使用过抗生素时,这三项指标均未检测到任何影响(P > 0.05,图 a)。在婴儿组中,取样前 15 天内或 15 天至 1 个月内接受过抗生素治疗的婴儿与未接受过抗生素治疗的婴儿相比,ARG 和 MGE 图谱均有所差异(<15 天,P < 0.001;15 天-1 个月,P 分别为 0.035、0.0095,图 b)。最近使用过抗生素的婴儿还表现出微生物群落组成的变化(<15 天,P <0.001,图 b)。但如果在取样前一个月以上使用过抗生素时,这些影响均不明显(P > 0.05,图 b)。
使用抗生素后对成人和婴儿的影响持续时间也反映在质粒丰度上。质粒可以在细菌细胞之间水平转移抗性和毒力基因。在成人肠道中,抗生素对质粒的影响可持续长达约 1 年。在取样前 6 个月内或 6 个月至 1 年内使用过抗生素的成人肠道中,质粒的总丰度高于对照组(Wilcoxon test;P < 0.001,图 c)。相反,取样前 1 年以上使用过抗生素的成人与未使用过抗生素的成人之间的质粒丰度没有差异(Wilcoxon test;P > 0.05,图 c)。同样,取样前使用抗生素超过 1 个月的婴儿肠道中的质粒丰度与未使用过抗生素的婴儿相比没有差异(Wilcoxon test;P > 0.05,图 d)。但是在取样前 15 天或 15 天至 1 个月内接受过抗生素治疗的婴儿肠道中的质粒丰度要高于对照组(Wilcoxon test;P = 0.03(0-15 天),P = 0.01(15 天-1 个月),图 d)。
图片来源:Nature Communications
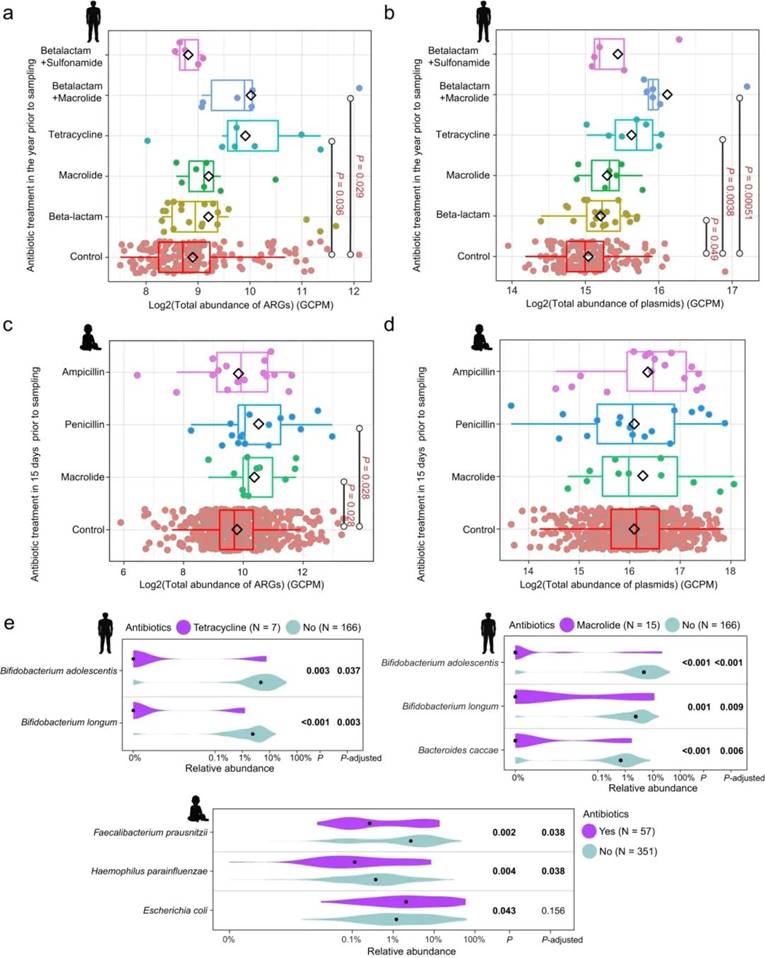
不同抗生素对成人和婴儿肠道微生物组的影响
与对照组相比,在取样前一年内接受过抗生素治疗的成人组中,研究人员调查使用不同的抗生素类型是否会对肠道微生物组的特征产生可检测到的影响。结果显示,除了 β-内酰胺+磺胺,其他类型的抗生素均与 ARGs 平均丰度增加相关,其中四环素和 β-内酰胺+大环内酯类的影响具有统计学意义(Wilcoxon test;adjusted P 分别为 0.036、0.029,图 a)。每种抗生素类型还与质粒平均丰度的增加相关,其中 β-内酰胺、四环素和 β-内酰胺+大环内酯类的影响具有统计学意义(Wilcoxon test;adjusted P 分别 0.049、0.038、0.00051,图 b)。在总共五种抗生素类型中,有四种与平均细菌丰富度降低相关(β-内酰胺+磺酰胺除外),并且所有五种抗生素类型都与平均 MGE 丰度增加相关。最后,使用四环素或大环内酯类抗生素会显著降低青春双歧杆菌和长双歧杆菌(20 个丰度最高的菌种中的 2 个)的相对丰度(Wilcoxon test;adjusted P < 0.05,图 e)。
在婴儿组中,研究人员评估了取样前 15 天内使用三种主要抗生素(大环内酯类、青霉素和氨苄西林)中的一种是否对婴儿肠道微生物组有显著影响。结果显示,无论使用哪一种抗生素,都与平均 ARG 丰度的增加相关,其中大环内酯类和青霉素具有统计显著性(Wilcoxon test;adjusted P 分别为 0.028、0.028,图 c)。此外,所有抗生素都与平均质粒丰度的非显著增加(Wilcoxon test;adjusted P > 0.05,图 d)和平均细菌丰富度的减少相关。大环内酯类和青霉素与平均 MGE 丰度的增加有关。三种抗生素均未对 20 个丰度最高细菌的丰度产生有统计学意义的影响。当进一步研究抗生素对更广泛的细菌群落的混合效应时,研究人员发现抗生素与普拉梭菌和副流感嗜血杆菌相对丰度的显著下降有关(Wilcoxon test;adjusted P < 0.05,图 e)。此外,研究人员还观察到大肠杆菌的丰度增加,尽管 adjusted P 并不显著。
图片来源:Nature Communications
综上所述,这项研究拓宽了我们目前对肠道耐药组动态以及抗生素治疗对各年龄段影响的认识。与婴儿相比,成人肠道中 ARGs 的比例、数量和丰度较低。与成人相比,婴儿的肠道微生物组从抗生素治疗中恢复得更快。暴露于抗生素后,不同抗生素对成人和婴儿肠道微生物组的影响不同。
文献原文:
Li, Xuanji et al. 「Differential responses of the gut microbiome and resistome to antibiotic exposures in infants and adults.」 Nature communications vol. 14,1 8526. 22 Dec. 2023, doi:10.1038/s41467-023-44289-6













